
编者按
心脏的作用是推动血液流动,向器官、组织提供充足的血流量,以供应氧和各种营养物质,并带走代谢的终产物,使细胞维持正常的代谢和功能。体内各种内分泌的激素和一些其它体液因素,也要通过血液循环将它们运送到靶细胞,实现机体的体液调节,维持机体内环境的相对恒定。
今天,我们特别关注一项于2022年3月发表在《Nature Communications》(IF:16.6)的经典研究——Human multilineage pro-epicardium/foregut organoids support the development of an epicardium/myocardium organoid,该研究报告了人类多谱系前心外膜/前肠类器官对心外膜/心肌类器官发育的影响。
01、研究背景
人类多能干细胞(hPSCs)及其分化成不同细胞类型的能力在过去几年中得到了深入的探索,其中主要包括开发多种器官的体外模型。具体来说,通过生成hPSC衍生的类器官,体外重现胚胎发育已经在多个组织中取得成功,包括大脑、肠道和肾脏。然而,在体外再现心脏早期发育阶段尤其具有挑战性,只有少数最新研究在一定程度上再现了心脏发生过程中的结构组织。
对心脏胚胎发育至关重要的一个结构是前心外膜(PE)。前心外膜是一种源自侧板中胚层(LPM)的瞬时结构,这一瞬时结构由心外膜祖细胞组成,这些祖细胞向发育中的心脏迁移,形成覆盖心肌的外上皮层——心外膜。心外膜不仅是支持和促进心肌功能性结缔组织形成的心脏成纤维细胞的主要来源,还是冠状动脉平滑肌细胞的主要来源,对冠状动脉血管的发育至关重要。此外,除了作为心脏细胞的祖细胞来源外,心外膜还能释放旁分泌信号,这些信号对诱导发育中心肌的增殖和成熟至关重要。
本文作者建立了一个人类多谱系类器官模型,它再现了前心外膜、横隔间充质和肝芽的共同发生。此外,作者还研究了WNT、BMP和视黄酸信号调控对多谱系类器官的影响。通过将这些类器官与心肌细胞球共同培养,研究人员生成了一个自组织的心脏类器官,包括一个完全包围心肌样组织的心外膜样层。这些心脏类器官模型再现了心外膜细胞对促进心肌细胞增殖以及结构和功能的影响,进一步体现心脏形成过程中心肌与心外膜的相互作用。
02、主要研究成果
1、PE聚合体在类似体内环境中再现前心外膜结构
研究人员评估了参与形成心肌细胞(CMs)和PE的重要基因表达的动态变化。结果显示,PE诱导后,心肌祖细胞的标志物 NKX2.5和ISL1的表达水平立即下降,而PE标志物WT1、TBX18、ALDH1A2和TCF21则明显上调。在本模型中,两种分化方案均观察到TBX5的表达随时间推移而增加,但PE分化方案的表达水平高于CM分化方案。GATA4的表达在两种方案的最初几天都有明显增加,到Day11时,与CM相比,PE中的GATA4表达水平更高。
为了更详细地了解细胞的组成并判定是否存在结构组织,研究人员用免疫荧光(IF)染色法对PE切片进行了分析。其证实了Day11时PE中存在LHX2+细胞,上皮结构周围的细胞染色更明显,而外围则没有或表达较少,WT1染色更明显。这一观察结果表明,WT1+细胞至少包括两种不同的细胞群,一种是WT1+/LHX2-/+low的PE样细胞群,定位于外围;另一种是WT1+low/LHX2+的横膈间充质(STM)样细胞群,定位于PE区域和上皮腔之间。
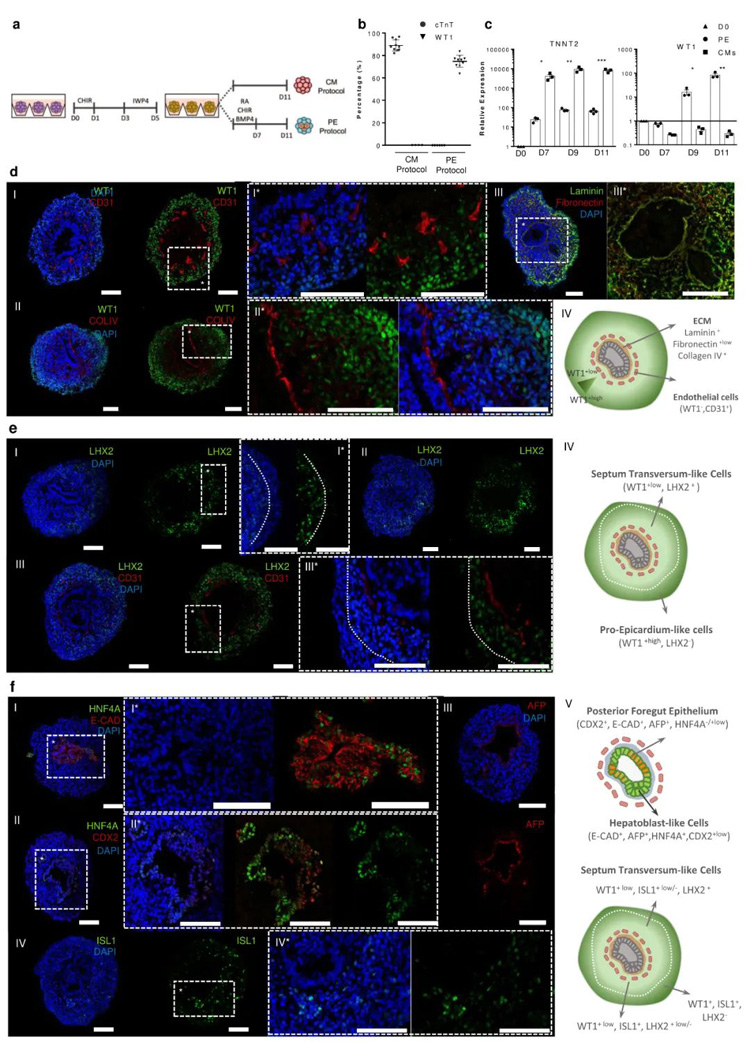
原文图1 PE/STM/PFH类器官再现前心外膜、横隔、后前肠和肝上皮芽的胚胎结构
2、双相WNT调节产生内胚层和中胚层祖细胞
研究人员通过流式细胞术分析CXCR4和c-KIT以及其他中胚层标志物KDR和PDGFRA,确定了祖细胞的不同亚群。在分化的Day5阶段,24±4%的细胞为CXCR4+/c-KIT+/KDR-/PDGFRA-,这意味着在这个时间点,聚集体中存在明确的内胚层(DE)祖细胞。
此外,分析细胞中有±5%是CXCR4-/c-KIT+/KDR+high的血管祖细胞。其余细胞为CXCR4+/c-KIT-/KDR+low/PDGFRA+,代表中胚层附属细胞群,占细胞总数的80±4%。
通过IF染色进一步分析发现,其存在中胚层(ISL1+)、内胚层(SOX17+)和血管细胞(CD34+)。PE/STM/PFH类器官来源于中胚层和内胚层祖细胞群,它们是在三维条件下通过对WNT信号进行时间调控而产生的。
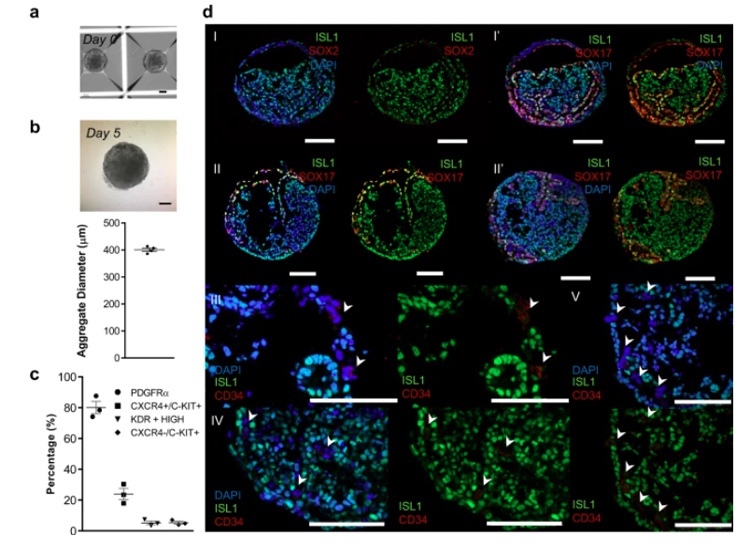
原文图2 由内胚层和中胚层祖细胞组成的细胞群(Day5 hPSC分化出的聚合体)
3、WNT和RA对PE/STM/PFH类器官的发育至关重要
研究人员通过流式细胞术以及IF染色分析发现,WNT和RA是PE/STM/PFH器官形成的关键因素;抑制RA通路的激活会导致肝芽器官的形成;在分化的Day5和Day7之间去除WNT信号的激活可使CM和PE/STM细胞群共同出现。
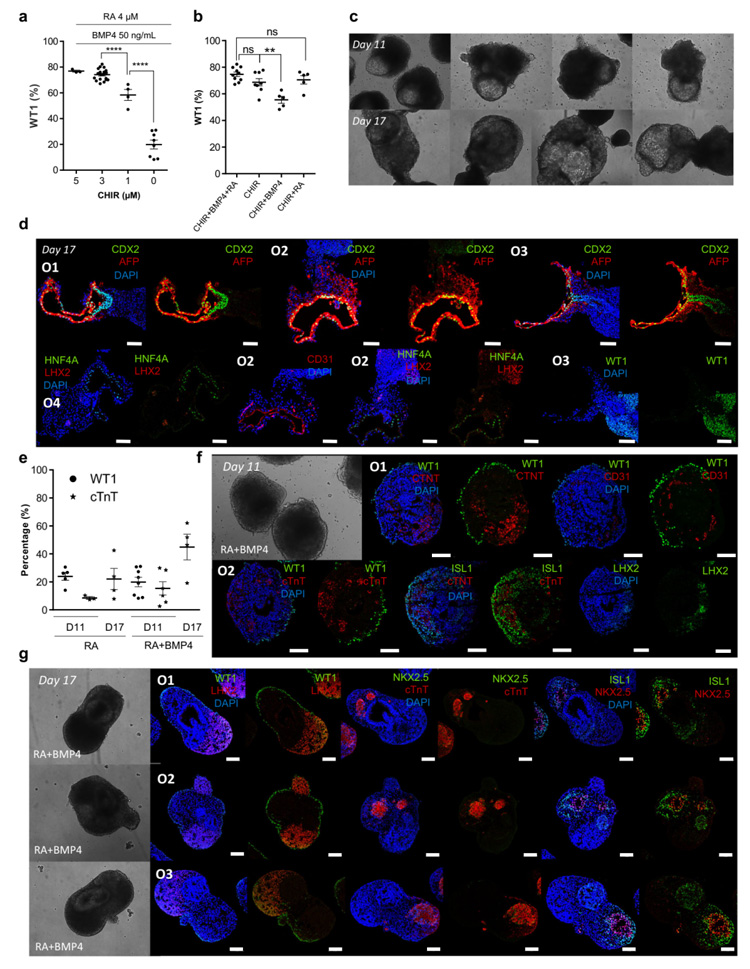
原文图3 WNT和RA是PE/STM/PFH类器官发育的关键信号
4、三维PE/STM/PFH细胞与CM共培养再现心外膜与心肌的相互作用
研究人员发现,在三维环境中将CMs与PE/STM/PFH细胞共培养,可启动细胞自组织过程,生成包含WT1+心外膜样层包围cTnT+心肌样组织的类器官。
通过分析显示,这些EMOs重现了以前与体内心外膜作用相关的重要过程,如心肌增殖和成熟等。此外,MZ中也存在CD31+细胞网络,表明EMOs中重现了冠状血管的形成。
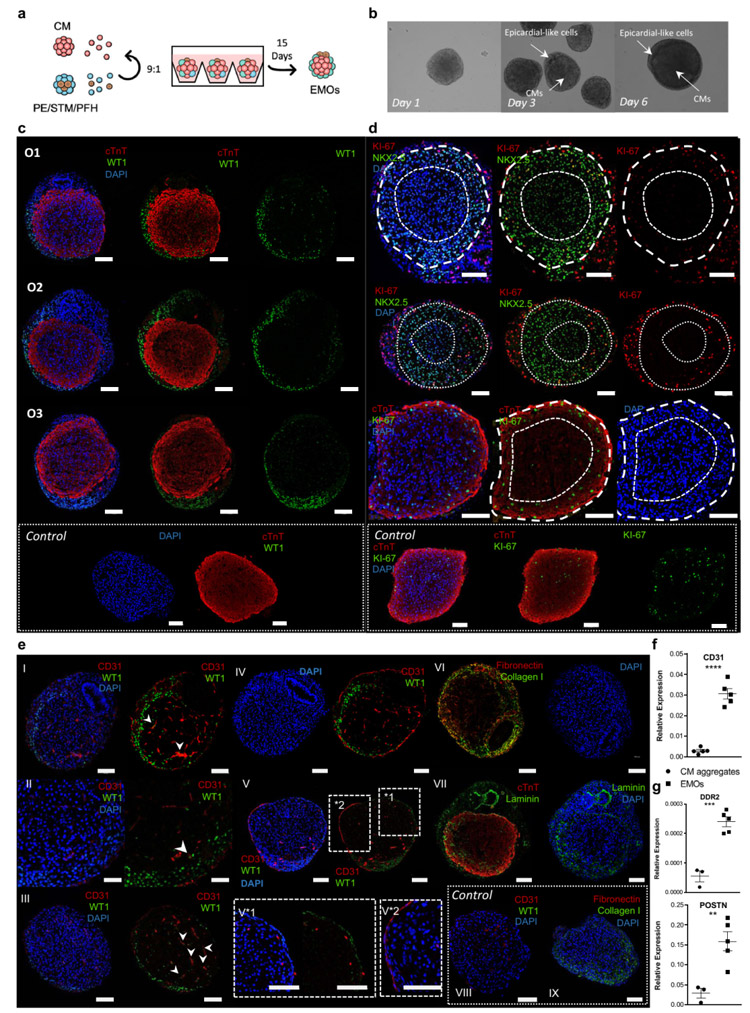
原文图4 PE/STM/PFH细胞与CMs共培养后形成的心脏类器官模型
5、WNT/BMP联合激活可增强后SHF/脏壁中胚层的分化
在hiPSCs分化的Day1和Day3阶段,BMP和WNT的联合激活可能会诱导RA通路的上调,从而产生早期轴旁中胚层祖细胞亚群,进而推动LPM祖细胞群从心脏中胚层向第二心场(SHF)/脏壁中胚层的分化。
WNT和BMP4信号通路在Day1-Day3分化期间的激活会影响CM的形成,但不会影响PE/STM的产生,而且WB条件下内胚层祖细胞的减少也会影响PE/STM/PFH类器官中上皮-前肠结构的发育。此外,研究结果表明,与在Day5进行WNT和BMP信号通路联合激活(WB)诱导PE/STM相比,从Day3 WB开始的PE/STM诱导更有利于形成类器官。
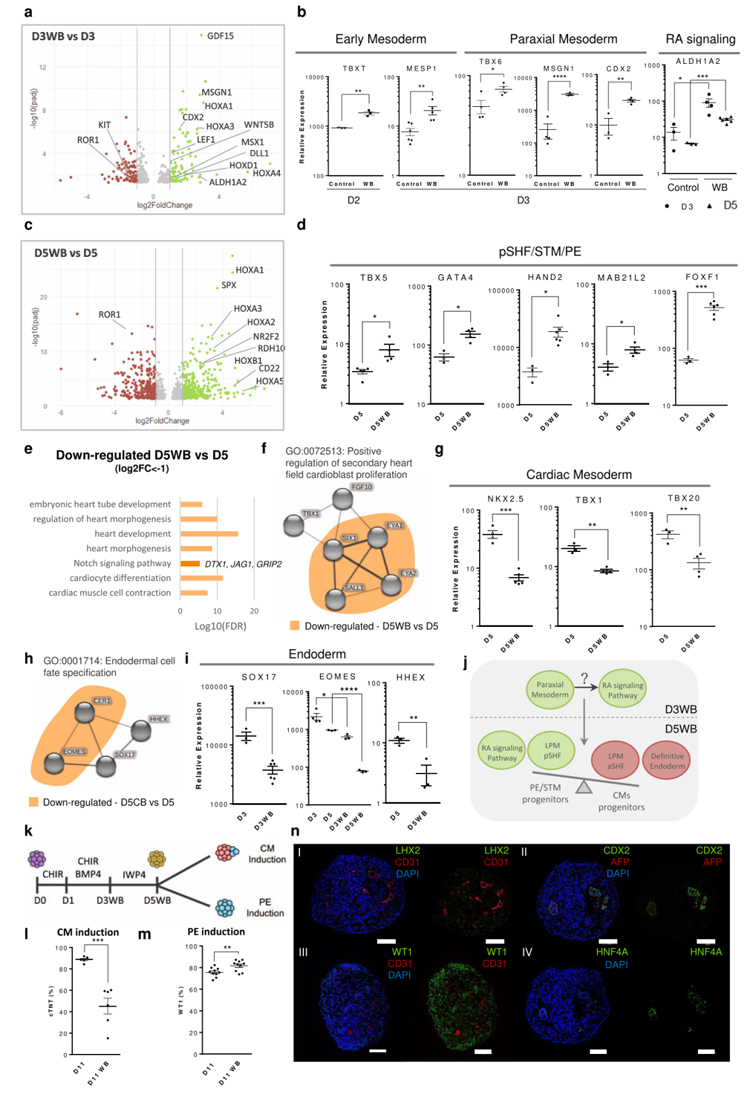
原文图5 WNT和BMP信号通路的长期联合激活通过RA信号激活诱导后第二心场(SHF)/脏壁中胚层的分化
03、编者点评
本文的研究结果凸显了多谱系PE/STM/PFH类器官模型的潜力,可用于研究人类PE/STM胚胎发生机制以及通过信号通路的组合调控实现肝实质和非实质细胞特化。此外,EMOs的生成简单且可重复,可呈现连续的心外膜样细胞层和模式化的血管样网络,为研究和模拟体外心外膜-心肌相互作用开辟了一条新的道路。这可进一步用于模拟先天性心脏病(CHD)的探索,如冠状动脉血管疾病和心肌非压迫性心肌病,以及作为胚胎心脏发育过程中的药物筛选和毒理学检测模型。
这是一项非常值得阅读的类器官研究,适合每一位想要开展“心脏类器官相关研究”的学者拜读,文中提出了诱导分化过程中的步骤,培养基配比以及细胞类型的鉴定方法等。其描述的人类心脏类器官模型为进一步了解健康或疾病情况下心脏形成过程中心肌与心外膜的相互作用开辟了道路。但本文研究人员并未对诱导成功的类器官进行功能学鉴定,损失了一定的指导意义。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已建立多种hiPSC诱导的类器官培养平台,欢迎有需要的读者垂询!
参考文献
1. Lewis-Israeli, Y. R. et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nat. Commun. 12, 5142 (2021).
2. Drakhlis, L. et al. Human heart-forming organoids recapitulate early heart and foregut development. Nat. Biotechnol. 39, 737–746 (2021).
3. Hofbauer, P. et al. Cardioids reveal self-organizing principles of human cardiogenesis. Cell 184, 3299–3317 (2021).
4. Tyser, R. C. V. et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science 371, 1–18 (2021).
5. Risebro, C. A., Vieira, J. M., Klotz, L. & Riley, P. R. Characterisation of the human embryonic and foetal epicardium during heart development. Development 142, 3630–3636 (2015).
6. Katz, T. C. et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev. Cell 22, 639–650 (2012).
7. Vrancken Peeters, M. P., Gittenberger-de Groot, A. C., Mentink, M. M. & Poelmann, R. E. Smooth muscle cells and fibroblasts of the coronary arteries derive from epithelial-mesenchymal transformation of the epicardium. Anat. Embryol. 199, 367–378 (1999).
8. Wessels, A. et al. Epicardially derived fibroblasts preferentially contribute to the parietal leaflets of the atrioventricular valves in the murine heart. Dev. Biol. 366, 111–124 (2012).
9. Cai, C.-L. et al. A myocardial lineage derives from Tbx18 epicardial cells. Nature 454, 104–108 (2008).
10. Volz, K. S. et al. Pericytes are progenitors for coronary artery smooth muscle. Elife 4, 1–22 (2015).
11. Cano, E. et al. Extracardiac septum transversum/proepicardial endothelial cells pattern embryonic coronary arteriovenous connections. Proc. Natl Acad. Sci. USA 113, 656–661 (2016).
12. Lupu, I.-E., Redpath, A. N. & Smart, N. Spatiotemporal analysis reveals overlap of key proepicardial markers in the developing murine heart. Stem Cell Rep. 14, 770–787 (2020).
13. Brade, T. et al. Retinoic acid stimulates myocardial expansion by induction of hepatic erythropoietin which activates epicardial Igf2. Development 138, 139–148 (2011).
14. Li, P. et al. IGF signaling directs ventricular cardiomyocyte proliferation during embryonic heart development. Development 138, 1795–1805 (2011).
15. Chen, T. H. P. et al. Epicardial induction of fetal cardiomyocyte proliferation via a retinoic acid-inducible trophic factor. Dev. Biol. 250, 198–207 (2002).
16. Merki, E. et al. Epicardial retinoid X receptor α is required for myocardial growth and coronary artery formation. Proc. Natl Acad. Sci. USA 102, 18455–18460 (2005).
17. Stuckmann, I., Evans, S. & Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev. Biol. 255, 334–349 (2003).
18. Kolterud, Å., Wandzioch, E. & Carlsson, L. Lhx2 is expressed in the septum transversum mesenchyme that becomes an integral part of the liver and the formation of these cells is independent of functional Lhx2. Gene Expr. Patterns 4, 521–528 (2004).
19. Iyer, D. et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development 142, 1528–1541 (2015).
20. Witty, A. D. et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat. Biotechnol. 32, 1026–1035 (2014).
