研究材料
技术路线
· 步骤1:用抗生素耗竭小鼠肠道菌群,导致IFN-I反应的基础水平降低,削弱抗病毒免疫;
· 步骤2:不同先天性免疫途径缺陷小鼠模型实验证实菌群驱动的IFN-I活化,依赖于宿主细胞中检测胞质DNA的cGAS-STING先天免疫通路的活化,而不是通过TLR信号或与宿主细胞的直接接触;
· 步骤3:体外、体内实验表明,在机制上:细菌产生的膜囊泡(MV)将细菌DNA输送到远端的宿主细胞中,从而激活cGAS-STING-IFN-I轴;
研究结果
1. 肠道菌群对于先天抵抗病毒感染至关重要
为了研究抗生素使用肠道菌群及病毒感染结果的影响,通过口服混合抗生素处理小鼠。2周后,对粪便细菌的16S rDNA测序和qPCR定量结果表明,抗生素处理小鼠的肠道细菌群落显著减少(图1 A-C)。当通过鼻内或腹膜内途径分别用HSV-1诱导局部肺部或全身感染时,口服抗生素小鼠中HSV-1复制更高且临床症状更严重(图1 D-H)。这些结果表明共生肠道细菌有助于全身抵抗病毒感染和保护远端器官。
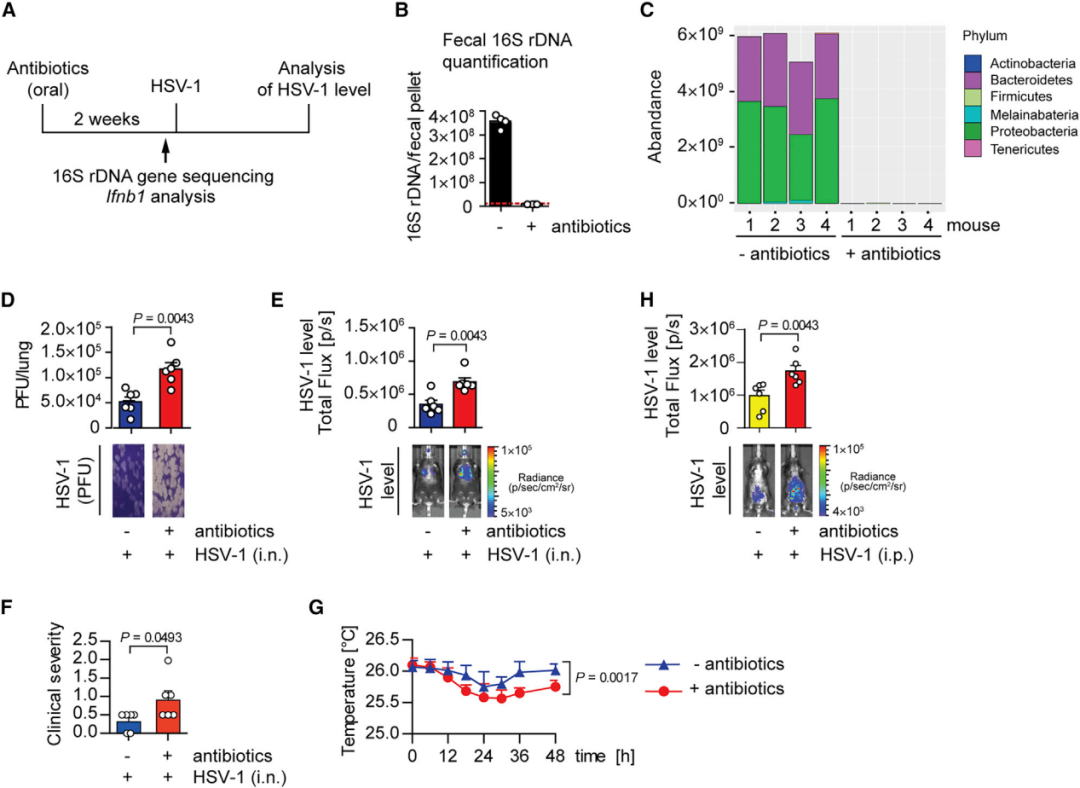
图1 肠道菌群对于抗病毒先天免疫至关重要
2. 肠道菌群通过STING驱动全身性IFN-I启动
基础IFN-Is对病毒感染的先天抗性至关重要。为了评估抗生素治疗后病毒复制增强是否是由于共生细菌对 IFN-I引发的可能影响,研究者检测了Ifnb1荧光素酶报告基因小鼠的基础IFN-I水平。口服抗生素导致全身基础Ifnb1水平降低(图2 A)。小鼠组织的RNA-Seq测序数据表明,口服抗生素小鼠中,干扰素刺激基因ISG和促炎细胞因子的表达降低(图2 B)。这些数据表明,肠道菌群对先天免疫启动至关重要,赋予宿主病毒感染抵抗力。
为了剖析哪些先天免疫通路有助于菌群驱动的IFN-I启动,研究者分析了缺乏不同先天免疫通路受体的Ifnb1荧光素酶报告小鼠(图2 C、D)。结果显示TLR通路存在缺陷小鼠的基础IFN-I反应没有显著变化(图2 E、F),这意味着全身性IFN-I启动在很大程度上与TLR无关。而STING(细胞质cGAS信号接头蛋白)通路存在缺陷的小鼠基础Ifnb1水平显著降低(图G-I),证明胞内核酸传感器对全身性IFN-I启动至关重要。
口服抗生素消除了WT和STING缺陷小鼠之间的IFN-I反应差异,而粪菌移植则可恢复WT小鼠中的Ifnb1反应(图2 J、K)。表明通过STING驱动全身性IFN-I启动反应由肠道共生细菌引发。此外,研究者观察到口服抗生素小鼠的STING蛋白水平没有下降(图2 L),这意味着观察到的基础IFN-I反应下降不是由于STING的丧失。
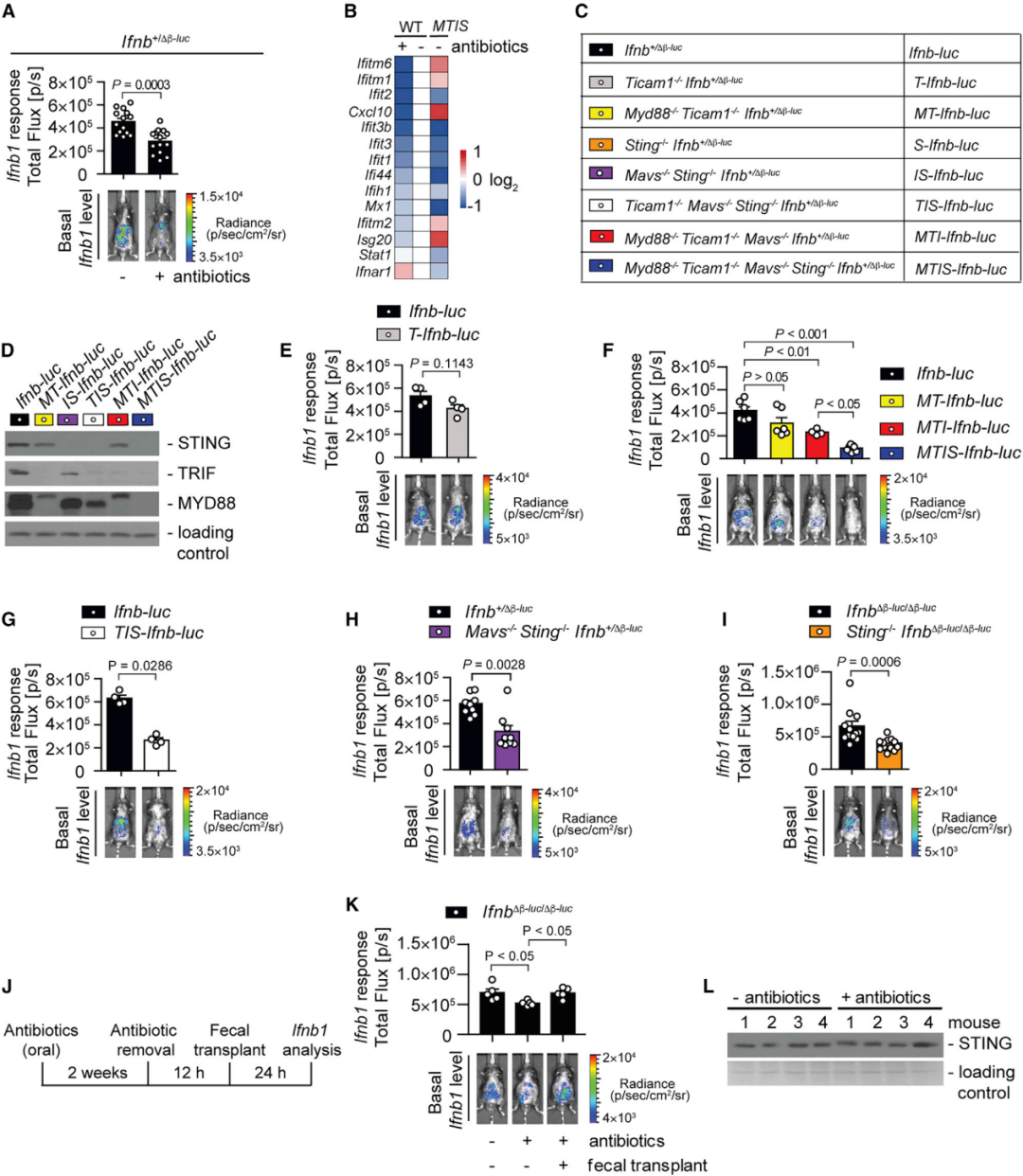
图2 肠道菌群引发的IFN-I涉及胞内STING途径
3. 细菌性MV启动STING-IFN-I轴以促进抗病毒先天免疫
当在transwell系统中与BMDM细胞共孵育时(防止细菌与宿主细胞直接相互作用),大肠杆菌突变体可诱导STING依赖性IFN-I反应(图3 A、B)。然而,在没有细菌与宿主细胞直接接触的情况下,细胞外细菌是如何能够触发STING-IFN-I轴的呢?过往的研究表明细菌能释放小型脂双层囊泡:MV,直径20~250 nm(图3 C)。MV可携带含有细菌成分的有效载荷,并可能穿过组织和细胞膜屏障。因此,研究者假设MV可能在通过细胞膜和组织传递细菌成分方面发挥作用,从而激活局部和远端的STING通路。为了验证这一假设,研究者纯化了大肠杆菌中的MV,并检查了它们在体内激活免疫反应的能力。大肠杆菌及其突变体的MV在形态上相似并且含有相当含量的DNA(图3 C、D)。在接种到腹膜腔后,来自大肠杆菌WT的MV在WT小鼠中诱导脓毒症症状,两者均引发了类似的Ifnb1反应,且MV暴露导致HSV-1感染的BMDM中STING磷酸化增加(图3 E-I)。此外,MV预处理使得小鼠对HSV-1感染具有更高的抗性(图3 J、K)。
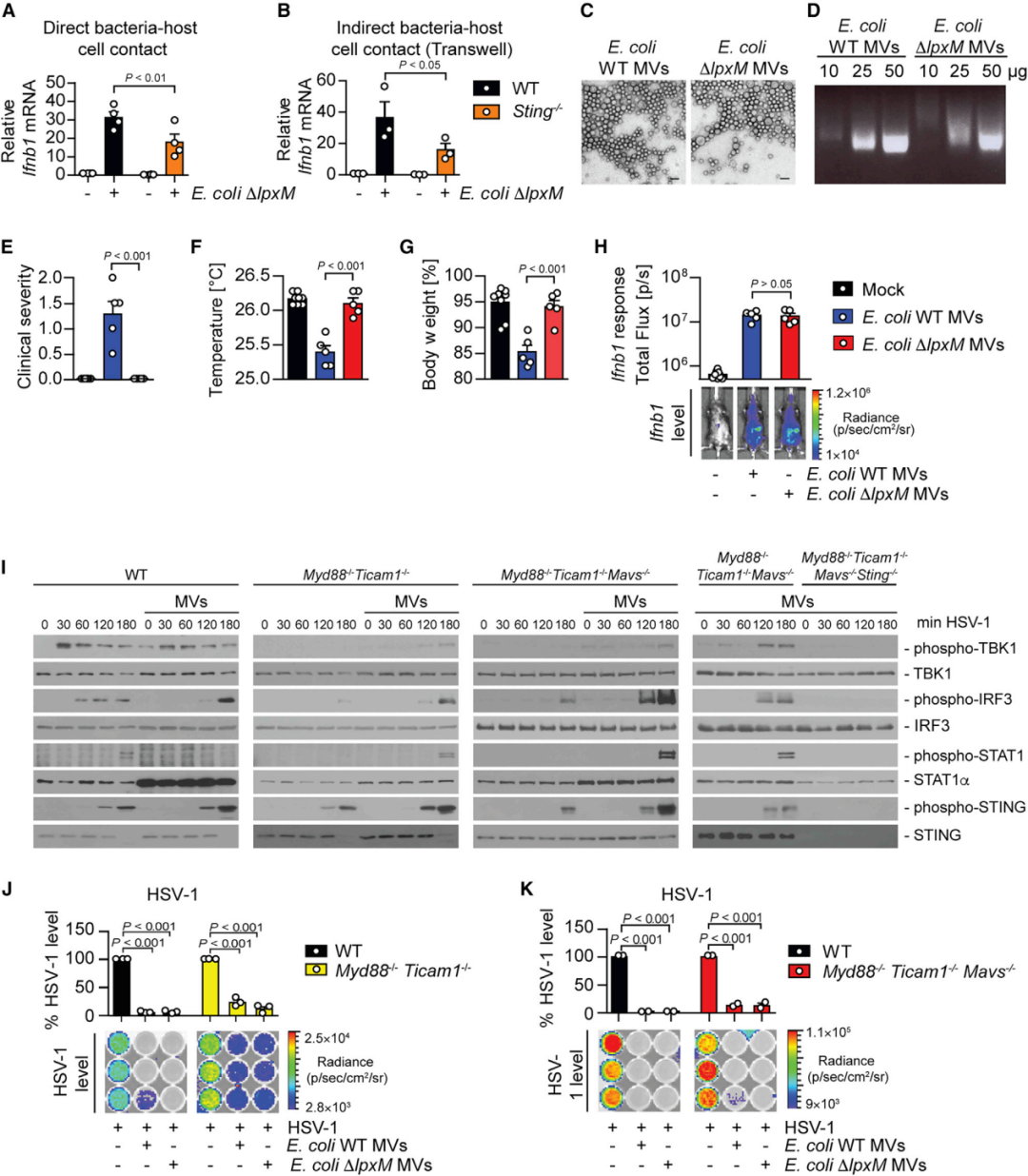
图3 专性细胞外细菌性MV启动STING-IFN-I轴以防止病毒感染
4. 细菌性MV将DNA递送到宿主细胞中以启动cGAS-STING-IFN-I轴
为了评估细菌性MV介导的IFN-I启动是否可以在体内赋予针对病毒感染的保护作用,研究者将大肠杆菌WT、突变体及其MV施用于小鼠。两周后,在诱导的IFN-I反应消退后,小鼠被HSV-1感染(图4 A)。结果显示活大肠杆菌或其MV显著提高两种小鼠模型对HSV-1的抗性(图4 B-D)。这些数据表明,细胞外细菌通过STING启动IFN-I系统,促进了小鼠对HSV-1的先天抗性。
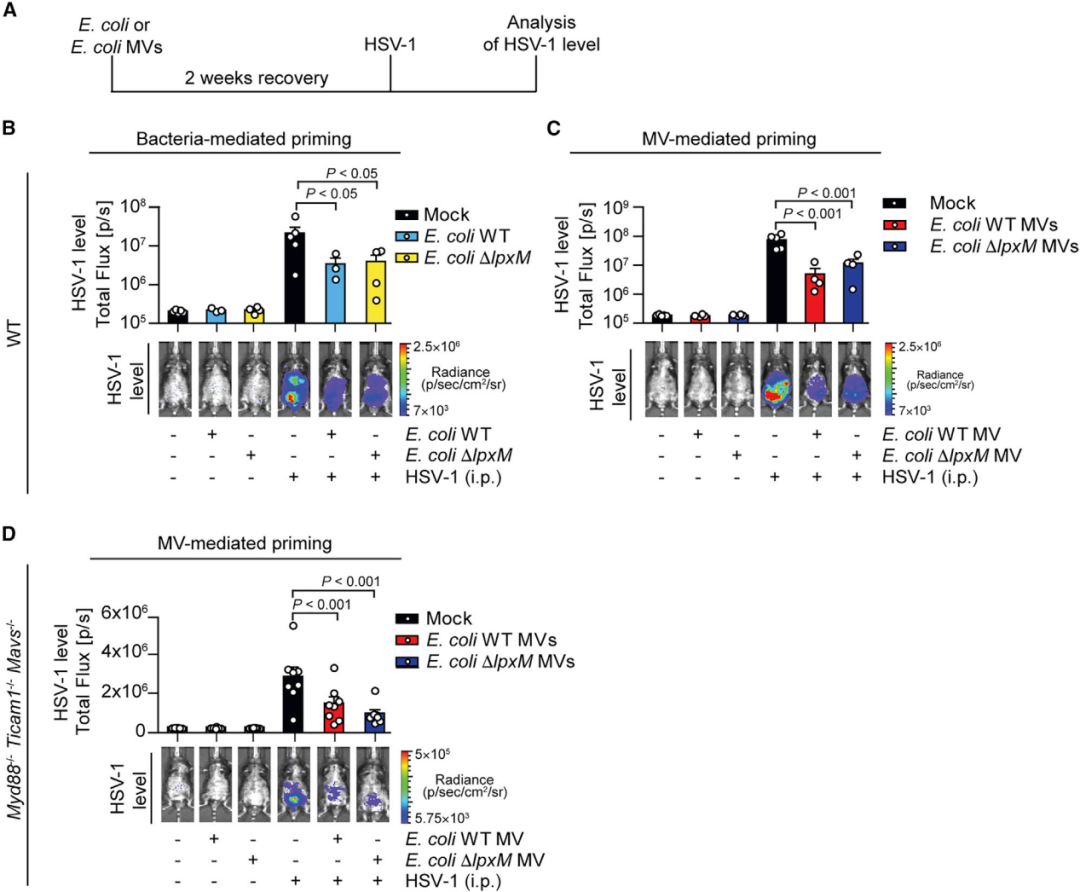
图4 细菌性MV启动STING-IFN-I轴以促进抗病毒免疫
琼脂糖凝胶分析显示MV中存在DNA(图5 A、B),在用苯甲酶处理以剥离囊外DNA后,MV仍然能够在小鼠和BMDM中诱导Ifnb1(图 5C 和 5D)。这些结果表明,MV将DNA包裹在其内部,以保护这些DNA免受细胞外核酸酶的影响,从而促进其递送到宿主细胞中,进而导致STING激活。当与细菌性MV一起孵育时,cGAS缺陷的HEK293细胞不会激活INF-I反应,除非cGAS的外源表达(图 5 E、F),这表明MV介导的IFN-I启动需要对细菌DNA感知的cGAS的参与。当缺乏cGAS或/和STING的BMDM或B16黑色素瘤细胞在transwell中与细菌或MV一起孵育时,引起的Ifnb1反应较低(图5 G、H)。以上结果表明细胞外细菌激活cGAS-STING途径,依赖于MV介导的细菌DNA向宿主细胞的传递(图5 I)。
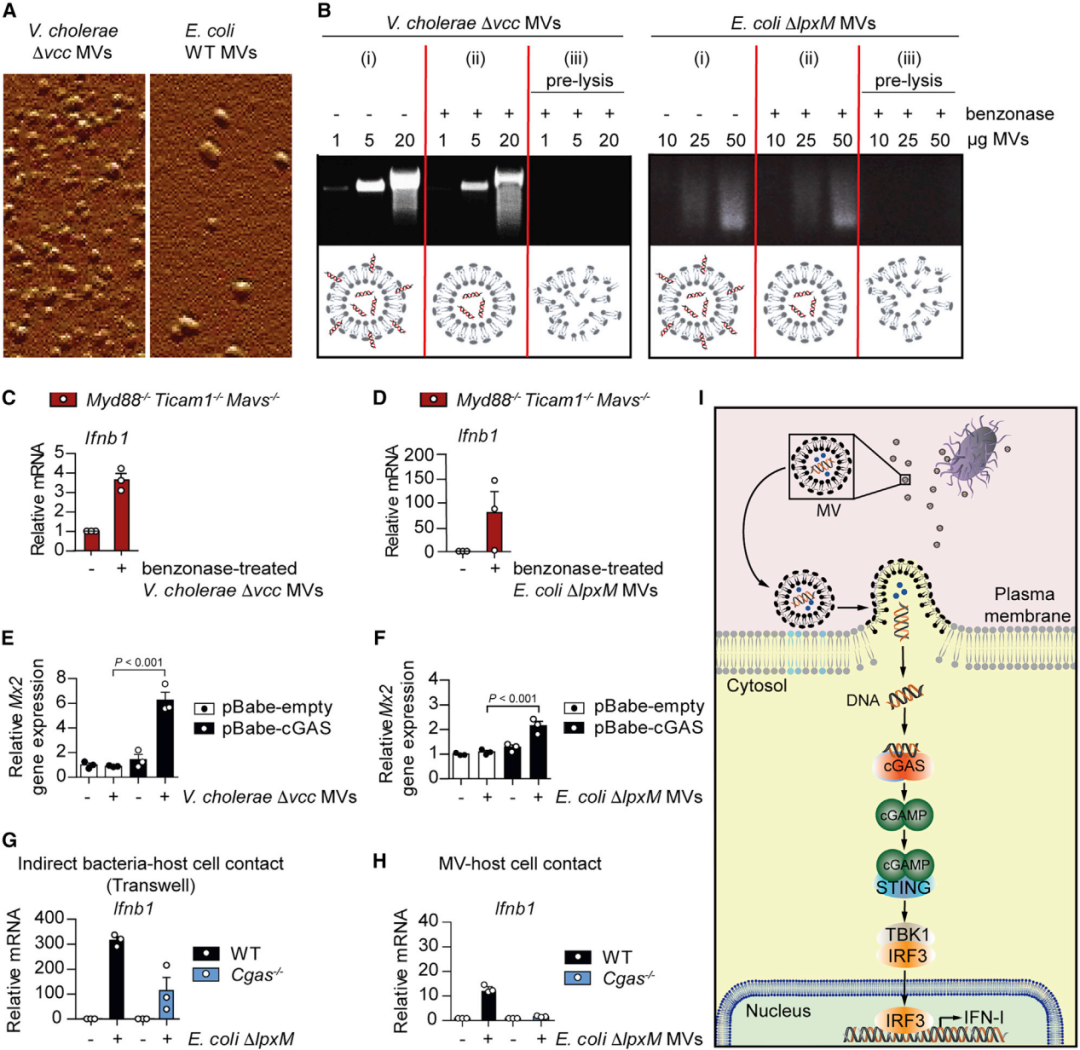
图5 细菌性MV包裹DNA并将其递送到宿主细胞质中以激活cGAS-STING-IFN-I信号传导
5. 肠道细菌来源的含有DNA的MV进入到血液循环并通过cGAS驱动全身性IFN-I启动
从小鼠粪便和血液中分离MV并进行16S rDNA测序,结果显示小鼠粪便和血液中含有载有细菌DNA的MV,主要来自厚壁菌门、拟杆菌门、变形菌门和放线菌门(图6 A、B)。这些数据表明,肠道细菌群落可以释放含有DNA的MV,同时存在于肠道和全身循环系统中。相较于对照小鼠,cGAS缺陷小鼠的IFN-I反应降低,抗生素处理消除了这种差异,小鼠同居过程中肠道菌群自发重新定殖的对照小鼠的基础IFN-I完全恢复,而cGAS缺陷小鼠IFN-I水平没有变化(图6 C),表明cGAS对于肠道菌群诱导的全身性IFN-I启动至关重要。上述结果证明肠道菌群产生的含有DNA的MV能够进入血液循环,解释了菌群驱动的全身性cGAS-STING依赖性IFN-I的启动,能够抵御DNA病毒的感染(图6 D)。
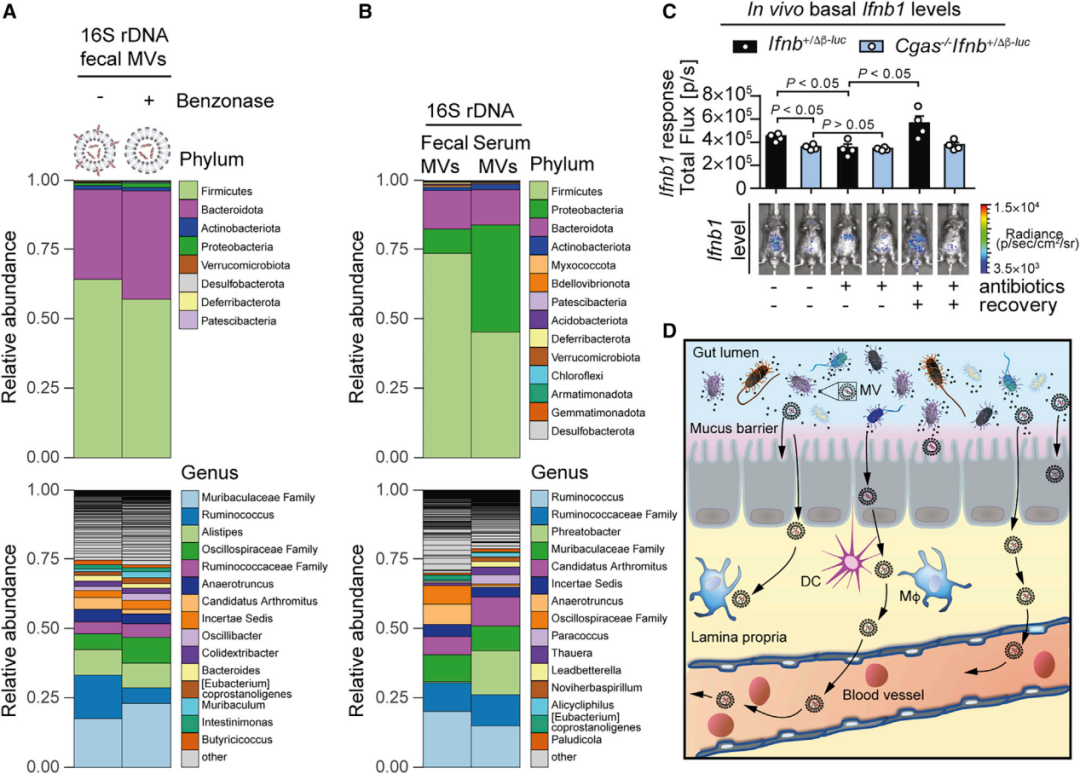
图6 肠道细菌将含有DNA的MV释放到血液中并通过cGAS驱动全身性IFN-I启动
6. 通过cGAS-STING启动菌群驱动的IFN-I可抵御RNA病毒
研究者进一步探索了cGAS-STING引发菌群驱动的IFN-I是否也可以提供针对RNA病毒的防护。当感染VSV时,相较于对照小鼠,STING缺陷小鼠和cGAS缺陷小鼠产生较弱的IFN-I反应且清除病毒的能力减弱,口服抗生素抵消了这种差异(图7 A-G)。这些结果表明,尽管cGAS-STING作为DNA传感器,但菌群驱动的通过STING引发的IFN-I启动也赋予了宿主对RNA病毒的先天抗性。
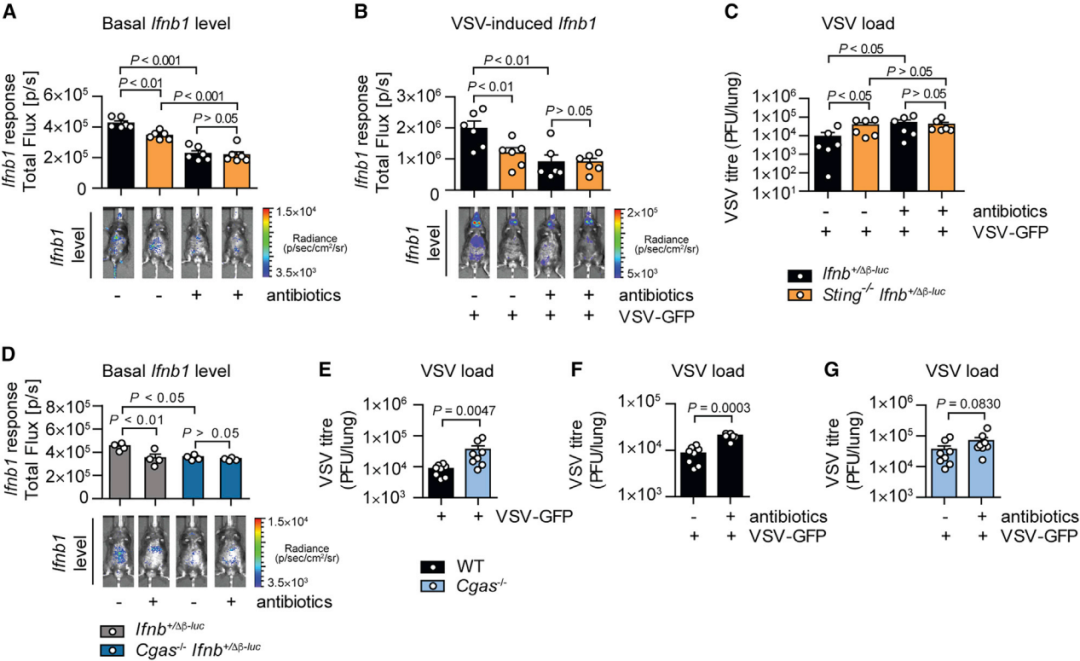
图7 通过cGAS-STING引发菌群驱动的IFN-I促进对RNA病毒VSV的抗性
小编小结
中科优品推荐
【中科新生命】全面推出肠道微生物群-免疫系统多组学解决方案,多角度、多层次、全方位深入挖掘肠道菌群和免疫系统之间的关联性,并结合表型结果,拟帮助科研人员开发一种新型干预性措施的潜在靶点。
肠-免疫-靶轴系统研究方案
16s/宏基因组----肠道微生物的组成及改变
免疫代谢组----肠道微生物产生的用于调控机体免疫的代谢物
免疫因子组----肠道微生物如何影响机体免疫
转录/蛋白质组----对终端靶器官应对炎症响应机制的系统描述