ef="https://book.yunzhan365.com/jtuc/rtoh/mobile/index.html">文章标题:Integration of Glucose and Cardiolipin Anabolism Confers Radiation Resistance of Hepatocellular Carcinoma
发表期刊:HEPATOLOGY
发表时间:2021.9.24
影响因子:17.4
合作客户:南方医科大学南方医院
百趣生物提供服务:代谢流检测分析及脂质组分析
研究背景
肝细胞癌是最常见的恶性肿瘤之一,具有预后不佳的特点,而放射治疗(RT)是少数几种临床可行的治疗方法之一,但由于固有的或获得性耐药,其疗效一直受到限制。最近,越来越多的证据表明,代谢重编程在几种癌症类型中起到辐射抵抗的促进作用。肿瘤代谢重新编程的中心组成部分之一是有氧糖酵解(也称为Warburg效应),其中间代谢产物葡萄糖可以被输送到合成代谢途径,如从头合成脂肪、氨基酸合成和核苷酸合成,从而促进肿瘤细胞的增殖和进展,抑制细胞凋亡。因此,葡萄糖经常作为肿瘤其他代谢途径的代谢基础,然而,代谢变化产生的代谢物如何以及哪些代谢产物与电离辐射(IR)诱导的细胞凋亡有关仍不清楚。在这里,作者通过比较不同肝癌细胞的代谢依赖性与固有或获得性放射抵抗描绘了抑制细胞凋亡驱动放射抵抗的综合代谢机制,并提出了破坏辐射增敏的代谢依赖性的治疗策略。
研究结果
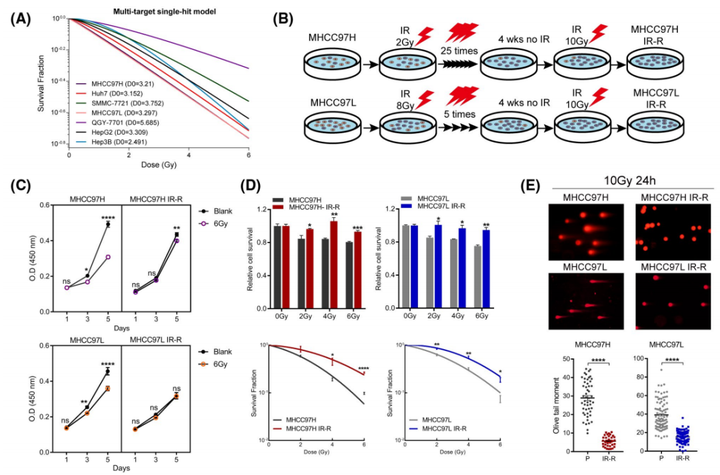
01.固有放射抵抗细胞系筛选与获得性放射抵抗细胞系培养
克隆形成分析显示,随着IR剂量的增加,肝癌细胞系的放射敏感性发生了变化(图1A)。值得注意的是,QGY-7701是使用的抗性最强的品系。由于MHCC97H和MHCC97L细胞系对IR相对敏感且克隆能力较弱,作者将它们分别暴露在常规或次分级IR中,目的是在不同的分割方案下产生获得性IR抗性(IR-R)亚系(图1B)。并通过细胞计数试剂盒8(CCK8)试验、MTT细胞毒性试验、克隆形成存活试验和中性彗星试验(图1C-E)确定了IR-R亚系的抗辐射状态。
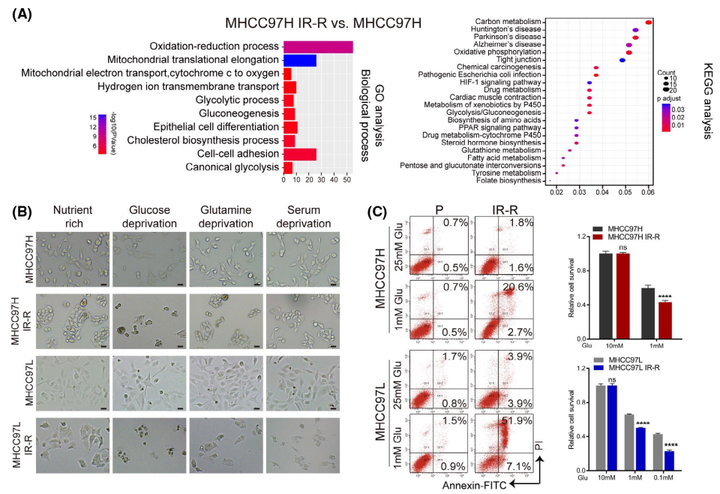
02.葡萄糖代谢增强了肝癌细胞的放射抗性
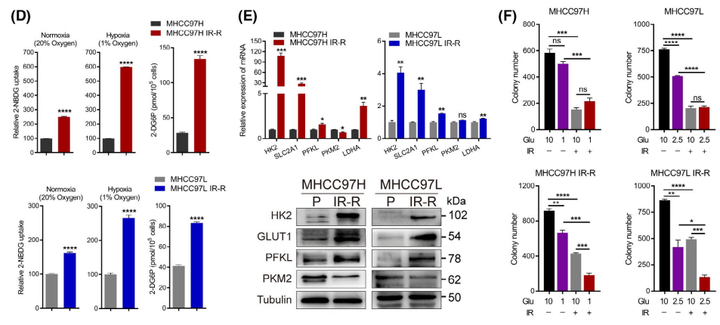
为了探索抗辐射的分子机制,作者观察到与MHCC97H对照组相比,MHCC97HIR-R抗辐射组中的多种代谢途径在蛋白水平上显著变化(图2A)。随后作者分别在葡萄糖、谷氨酰胺或血清剥夺条件下培养细胞,以检测抗辐射细胞的能量来源;并以营养丰富的条件作为对照。与最近表明葡萄糖代谢具有辐射防护作用的报告一致,只有剥夺葡萄糖会促进IR-R细胞的死亡(图2B)。由于大多数高度依赖葡萄糖的癌细胞在受到葡萄糖阻断时往往会被迫发生凋亡,因此可以发现抗辐射细胞在低糖条件下表现出显著的凋亡和存活率降低(图2C)。IR-R细胞表现出比它们的亲代对照细胞更高的葡萄糖摄取量,并且在低氧条件下差异更大(图2D)。同时参与葡萄糖代谢的酶,如HK2、GLUT1、SLC2A1和PFKL,在IR-R细胞中的表达也增加;IR和低糖培养条件的结合协同导致IR-R细胞中克隆形成的存活率大大降低,但在亲代细胞中则没有发生这种现象(图2E,F)。总而言之,这些发现证实了抗辐射的肝细胞癌细胞对葡萄糖的依赖性增加。
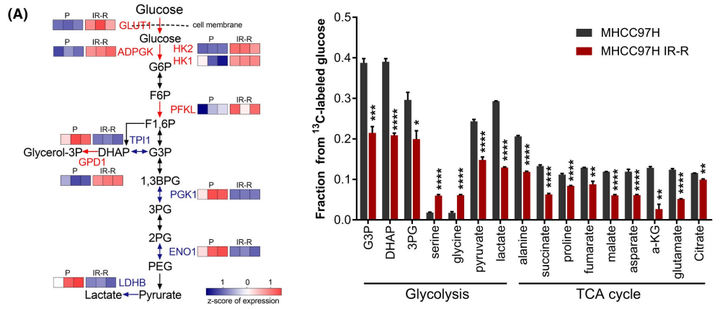
03.葡萄糖对心磷脂合成的增强促进了放射抵抗肝癌细胞细胞色素c的释放
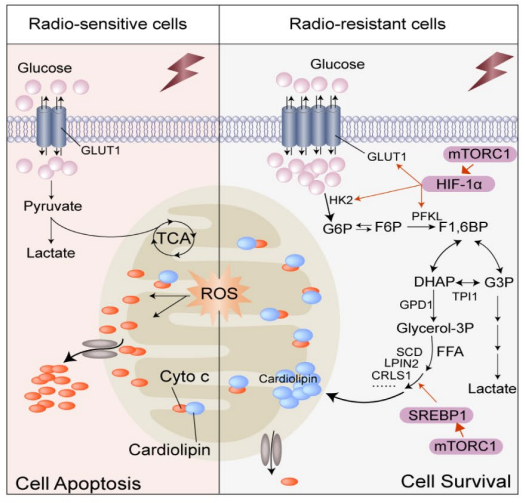
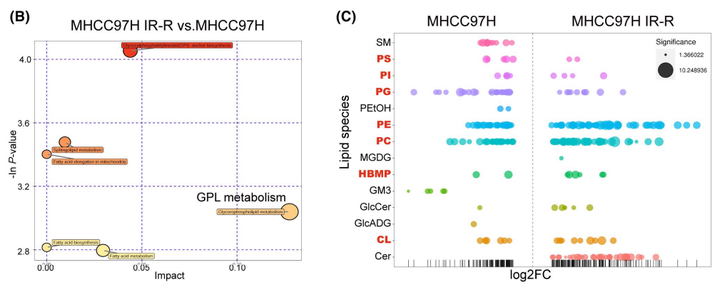
为了进一步明确葡萄糖在亲本细胞和抗辐射细胞中的流向变化,进而探究葡萄糖是通过怎样的代谢重编译来增强肝癌细胞对放射的抵抗能力,作者进行了U-13C葡萄糖示踪的代谢流质谱分析。通过代谢流实验作者发现,在MHCC97H细胞中,葡萄糖流向主流糖酵解代谢产物和三羧酸(TCA)循环衍生代谢物的速度比IR-R细胞快,而在IR-R细胞中,葡萄糖流向分支代谢物(如丝氨酸和甘氨酸)的流量增加。结合相关蛋白表达量数据和IR-R细胞中较高的HK2活性但较低的乳酸含量,作者推测IR-R细胞可能通过灵活组装分配糖酵解的中间代谢物以增强分支合成代谢来对抗辐射(图3A)。通过非靶代谢组的实验作者进一步发现甘油磷脂(GPL)的代谢通路发生了显著的变化(图3B)。而因为GPL的合成需要依赖于游离脂肪酸和甘油-3-磷酸,甘油-3-磷酸又来源于脱氢二羟丙酮磷酸(DHAP),所以GPL的合成正好将葡萄糖代谢与脂代谢所串联在一起。而在各种GPL中,心磷脂(CLS)是一种结构独特的磷脂,仅在线粒体中合成。早期研究表明,CL水平的增加可以加强细胞色素c的膜结合,从而使细胞在受到凋亡刺激时更有可能存活。由于细胞色素c介导的凋亡是IR引起的主要死亡方式之一,为了探究CL合成是否与辐射抵抗有关。作者首先进行了脂质组学研究,以确定MHCC97H亲本细胞和IR-R细胞中脂质谱的整体变化。结果表明,IR-R细胞内显著积聚的脂质主要由GPLs组成。更重要的是,与亲本细胞相比,IR-R细胞中磷脂酰甘油(PG;CL合成酶1[CRLS1]消耗的脂类)的种类减少,而CL合成的种类增加,这意味着CL合成的增强(图3C)。
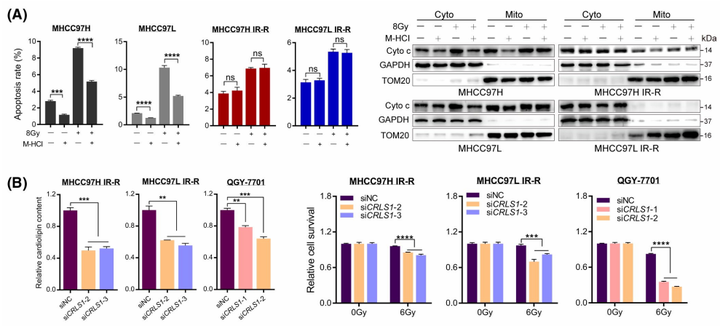
为了研究细胞色素c的潜在作用。作者随后使用了抑制细胞色素c释放的小分子盐酸二甲胺四环素(M-HCl)来处理细胞。通过前期实验发现到IR后亲代细胞中细胞色素c的在胞浆中增加了,M-HCl处理显著恢复了IR诱导的细胞凋亡,而在IR-R和QGY-7701细胞中没有观察到这种变化或恢复作用,表明细胞色素c的释放在一定程度上被阻止在辐射抵抗的肝癌细胞中(图4A)。为了进一步确定该块是否依赖CLs,我们针对CRLS1产生了小干扰(si-)RNA来预处理抗辐射细胞。结果表明,在被试细胞中抑制CRLS1可以相应地促进细胞色素c的释放,降低细胞CL含量,并在IR处理时显著增加细胞死亡(图4B)。总而言之,这些数据表明,葡萄糖和CL合成代谢的整合通过调节肝癌细胞中细胞色素c的分泌来调节辐射抗性。
04.mTORC_1通过促进HIF-1α和SREBP_1的翻译介导肝癌细胞的辐射抗性
根据前文的数据显示,低氧进一步扩大了IR-R和亲本细胞对葡萄糖的吸收差异(图2D),同时IR-R细胞中缺氧诱导因子-1(HIF-1)的信号增加。为了探究抗辐射细胞的葡萄糖依赖是否受HIF-1α调控。当转录调控葡萄糖合成代谢时,HIF-1α会使mTORC1信号的激活,mTORC1信号是刺激类固醇调节元件结合蛋白1(SREBP1)调节脂肪生成所必需的。
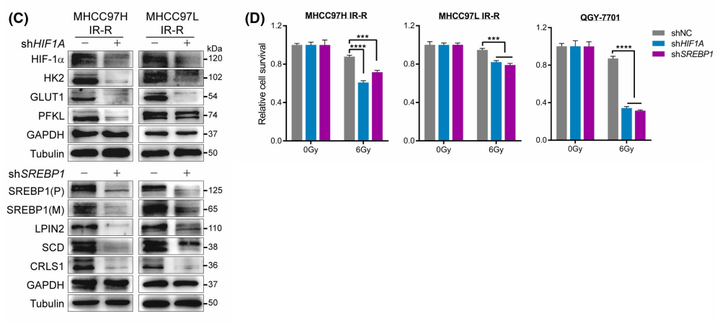
作者接下来构建了HIF-1α和SREBP1下调的抗辐射肝癌细胞系。结果表明,具有HIF-1α或SREBP1基因敲除的耐药细胞分别抑制了参与葡萄糖代谢或CL合成的下游代谢靶点(图4C)。在功能上,抑制HIF-1α或SREBP1可显著降低放射抗性,减少细胞CL含量,并加速IR诱导的耐药肝癌细胞细胞色素c的释放(图4D)。随后作者通过对HIF-1α或SREBP1多聚体的检测发现,mTORC_1并非是在转录水平,而是在转录后翻译阶段介导了肝癌细胞的辐射抗性。
研究小结
综上所述,该研究破译了葡萄糖和CL合成代谢的整合,由mTORC1HIF-1α/SREBP1信号调节,通过抑制获得性和内在放射抵抗的肝癌细胞中细胞色素c的释放来介导辐射抵抗(图5)。随着RT在肝癌治疗中的逐步兴起,了解这种代谢性肿瘤的代谢脆弱性并阐明其潜在的机制可能有助于确定对肝癌患者进行更有效的综合治疗。