阿尔茨海默病(AD)和帕金森病(PD)是与年龄相关的两种最常见的神经退行性疾病。迄今为止,仍然无法完全治愈,仅有非常有限的缓解治疗选择。然而,在分子水平上,蛋白质错误折叠、积累、聚集以及沉积物的形成是包括AD和PD在内的许多神经疾病的常见特征。因此,神经退行性疾病可能具有共同的触发因素,最新研究数据表明α-突触核蛋白(α-Syn)和Tau可能相互作用,这种相互作用对神经退行性疾病的发展和传播至关重要。
[疾病·导向]蛋白折叠
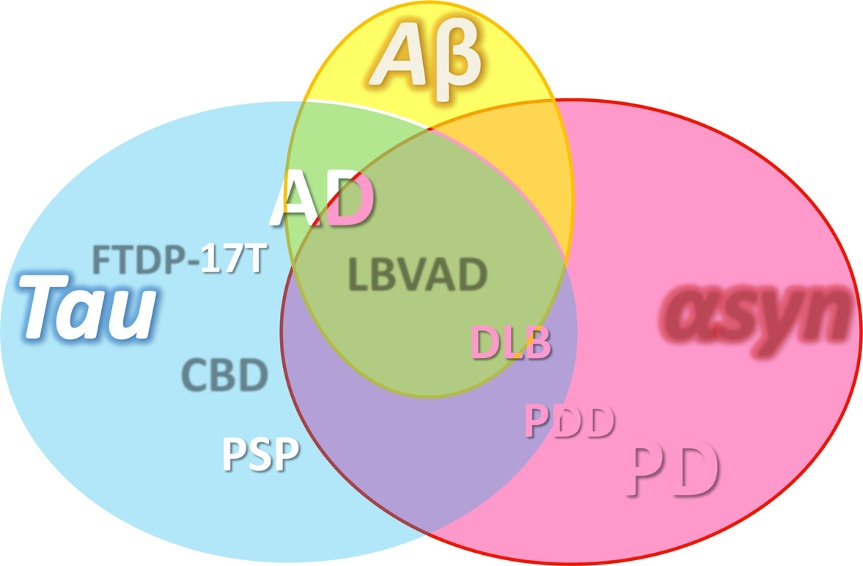
与蛋白质折叠相关的多种疾病重叠
[免疫·当下]策略解读
针对α-Syn的免疫治疗策略
尽管对α-Syn的免疫机制尚未完全了解,但现行针对错误折叠的α-Syn有两种抗体导向模式:① 结合胞外α-Syn并通过小胶质细胞介导的降解刺激其清除;② 靶向受体细胞的膜表面受体,以抑制病理性α-Syn的结合。临床研究中针对α-Syn的免疫主要通过被动免疫和主动免疫两种方式实现,被动免疫的优势在于抗体可特异性结合α-Syn,作用迅速并具可逆性,但需要重复剂量;主动免疫能够积极地诱导产生特异性抗体的免疫反应,优点是剂量需求少且具有持续效果,但目前未有研究能达到主要和次要终点。因此,有学者指出可能单独靶向于α-Syn是不够的,需要与其他相关作用机制的药物进行组合。
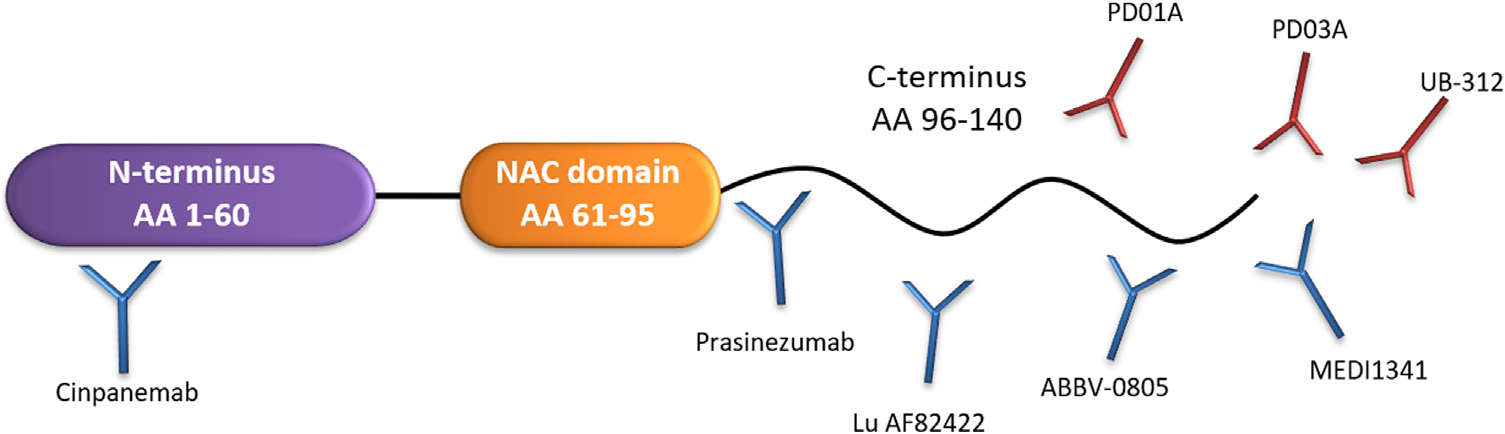
针对a-Syn的免疫策略
目前针对原发性Tau相关疾病的免疫策略主要是靶向细胞外Tau,且开发中的Tau抗体主要针对蛋白质的N端。尽管我们对Tau靶向抗体作用机制的理解有所进步,并且有令人鼓舞的临床前数据,但两项针对Tau N端单克隆抗体的随机对照试验未能达到其主要疗效终点。相关证据表明,就细胞外空间丰度和Tau的病理和聚集机制的生物学相关性而言,Tau的N末端可能不是合适的靶点。同时,临床前证据似乎表明,靶向于蛋白折叠结构域的Tau中间区域可能在阻断Tau扩散方面具有优势。
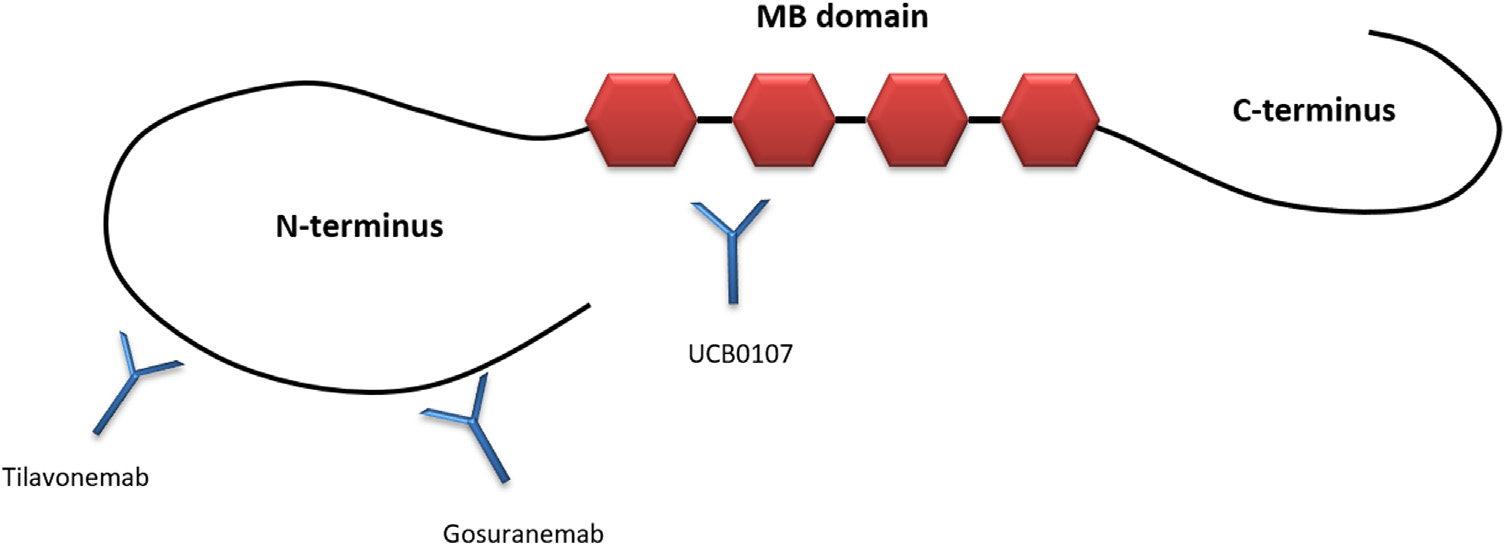
针对Tau的免疫策略
[曙光·初现]交互作用
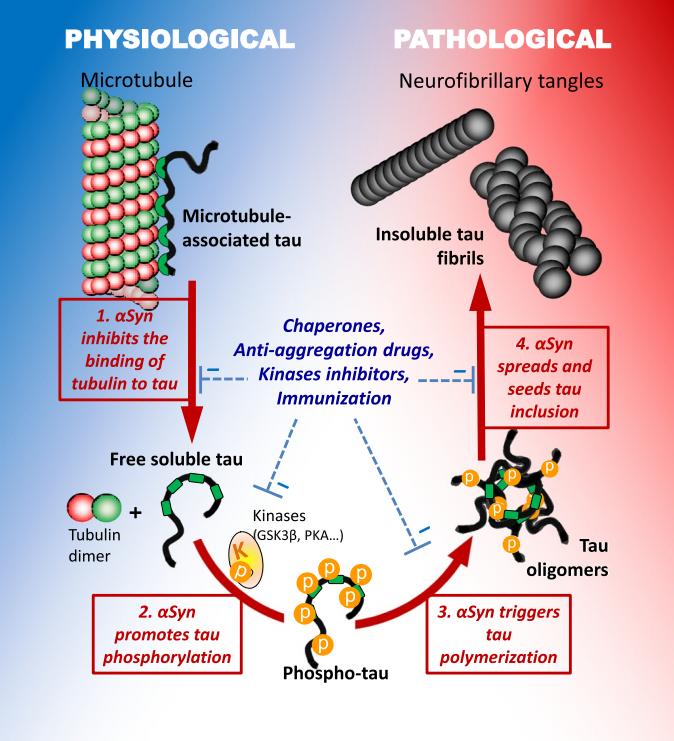
Tau蛋白与α-Syn蛋白相互作用的假设途径
[黎明·将至] 联合治疗
α-Syn和Tau之间的重叠和许多相似之处表明,针对共同的Tau和α-Syn聚集过程的治疗策略可以使神经退行性疾病的患者受益,并可能特别适用于治疗继发症状,如PD中的认知障碍或痴呆中的继发性帕金森病。同时,学者对α-Syn和Tau相互作用的反复体外和体内观察也高度表明,α-Syn和Tau作为队友发挥协同作用,但这种相互作用是如何发生并影响神经退行性过程的,目前尚未完全阐明。尽管如此,即使在α-Syn和Tau之间相互作用的机制和作用方面仍存在一些灰色地带,但其应用和未来方向已经出现。目前已经浮出的发展方向是鉴定可靠的生物标志物,以便在前期有效诊断神经退行性疾病,例如:α-Syn和Tau目前正被开发为用于临床诊断改善的脑脊液生物标志物。
综上,解读α-Syn和Tau等蛋白质之间的相互作用可以加速临床确定患PD、AD等混合性疾病的风险,并为患者快速提供所需治疗窗口,以开展针对性预防和定制治疗。
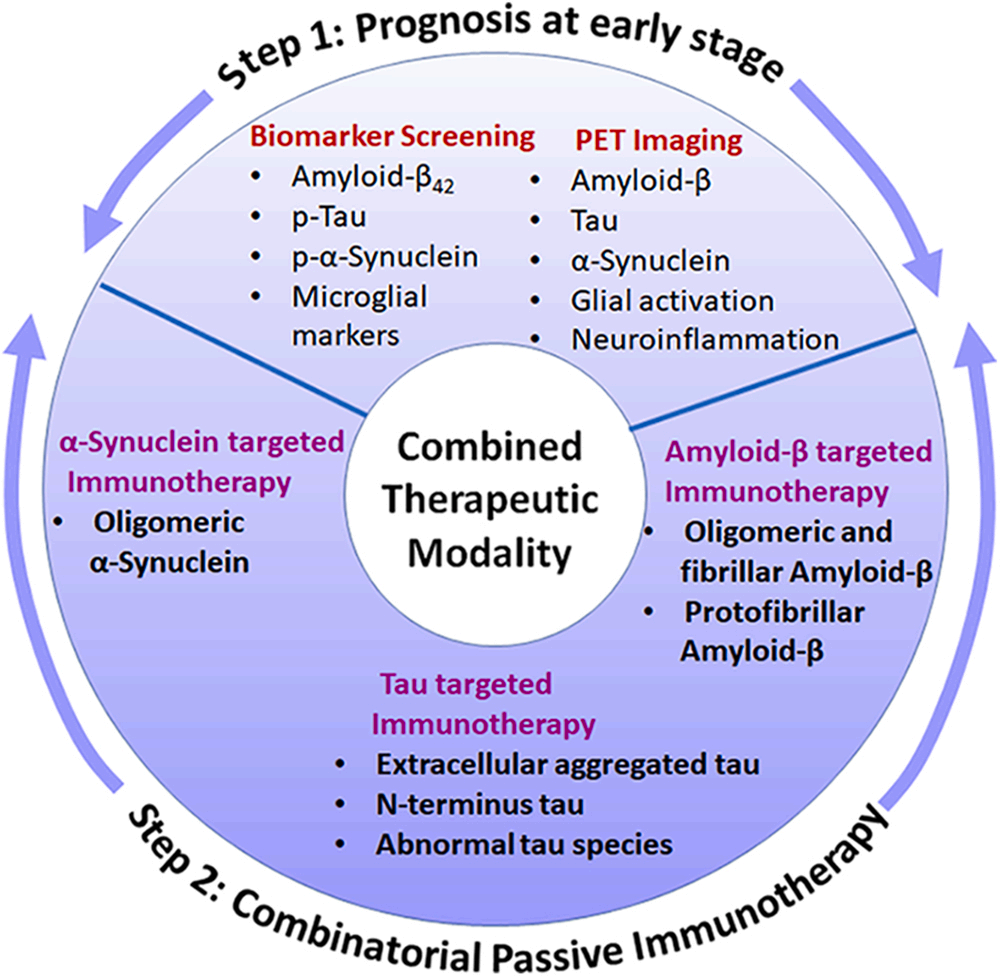
增强疾病干预的联合治疗方式
ACROBiosystems百普赛斯开发了一系列Alpha-Synuclein /Tau重组蛋白,助力PD /AD及其他相关神经退行性疾病诊断方案及治疗药物研发。
✍ 高纯度及高均一性单体经SDS-PAGE及SEC-MALS验证
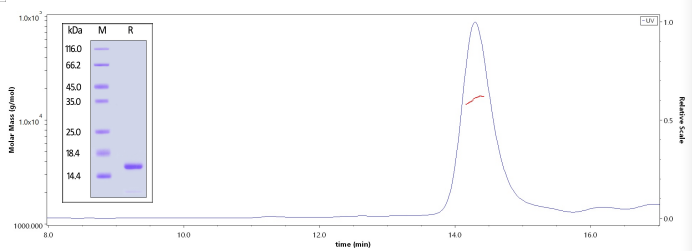
经SDS-PAGE验证,Human Alpha-Synuclein, Tag Free (Cat. No. ALN-H5214)纯度高于 95%;经 SEC-MALS 验证,其纯度高于 90%,分子量为13-19 kDa。
✍ 高生物活性经抗体结合验证
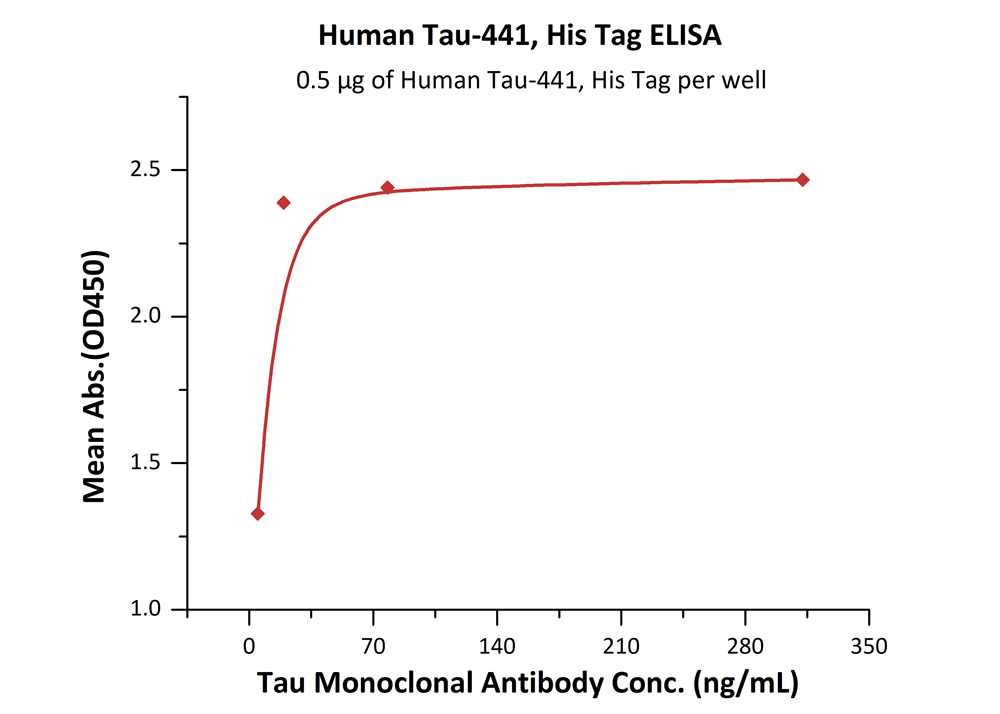
经ELISA验证,Human Tau-441, His Tag (Cat. No. TAU-H51H3)可特异性结合Tau Monoclonal Antibody,线性区间为5-20 ng/mL。
点击了解更多PD药物研发相关蛋白
| Alpha-Synuclein | DDC | MAOA |
| MAOB | LRRK2 | ... |
点击了解更多AD药物研发相关蛋白
| APOE | APP/A beta | ACHE | BACE1 | BCHE |
| GSK-3beta | Tau | TREM2 | NPTX2 | GRIN2B |

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)
参考文献
1. Lopez-Cuina M, Meissner W G. Targeting alpha-synuclein or tau for treating neurodegenerative movement disorders[J]. Revue Neurologique, 2022.https://doi.org/10.1016/j.neurol.2022.03.010.
2. Sengupta U, Kayed R. Amyloid β, Tau, and α-Synuclein aggregates in the pathogenesis, prognosis, and therapeutics for neurodegenerative diseases[J]. Progress in Neurobiology, 2022: 102270. https://doi.org/10.1016/j.pneurobio.2022.102270.
3. Canever J B, Soares E S, de Avelar N C P, et al. Targeting α-synuclein post-translational modifications in Parkinson’s disease[J]. Behavioural Brain Research, 2022: 114204.https://doi.org/10.1016/j.bbr.2022.114204.
4. Vacchi E, Kaelin-Lang A, Melli G. Tau and alpha synuclein synergistic effect in neurodegenerative diseases: When the periphery is the core[J]. International journal of molecular sciences, 2020, 21(14): 5030.https://doi.org/10.3390/ijms21145030.
5. Moussaud S, Jones D R, Moussaud-Lamodière E L, et al. Alpha-synuclein and tau: teammates in neurodegeneration?[J]. Molecular neurodegeneration, 2014, 9(1): 1-14.http://www.molecularneurodegeneration.com/content/9/1/43.
